VYEPTIMD A RÉDUIT SIGNIFICATIVEMENT LE NOMBRE DE JOURS AVEC MIGRAINE PAR MOIS
COMPARATIVEMENT AU PLACEBO CHEZ DES PATIENTS AUX PRISES AVEC UNE MIGRAINE ÉPISODIQUE (ESSAI PROMISE-1) ET AUX PRISES AVEC UNE MIGRAINE CHRONIQUE (ESSAI PROMISE-2)
(Paramètre principal : réduction du nombre moyen de JMM par rapport aux valeurs initiales; VyeptiMD -7,7, placebo -5,6, p < 0,0001; différence vs placebo = -2; IC à 95 % [-2,9 à -1,2]1,2)
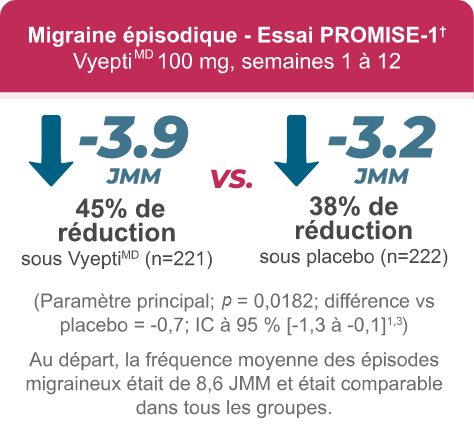
(Paramètre principal : réduction du nombre moyen de JMM par rapport aux valeurs initiales; VyeptiMD -3,9, placebo -3,2, p=0,0182; différence vs placebo = -0.7; IC à 95 % [-1,3 à -0,1]1,3)
VyeptiMD (eptinézumab pour injection) est indiqué pour la prévention de la migraine chez l’adulte ayant au moins 4 jours avec migraine par mois.
VyeptiMD doit être prescrit par un professionnel de la santé ayant de l’expérience dans le diagnostic et le traitement de la migraine.
UNE PERFUSION I.V. DE 30 MINUTES TOUTES LES 12 SEMAINES
coordonnée par

TAUX DE RÉPONDEURS (JMM)
MIGRAINE CHRONIQUE – ESSAI PROMISE-2
Une réduction ≥ 75 % du nombre de JMM par rapport aux valeurs initiales a été obtenue chez 27 % des patients sous VyeptiMD vs 15 % des patients sous placebo1,2 (paramètre secondaire majeur)
 D'après la monographie de produit
D'après la monographie de produit
Une réduction ≥ 50 % du nombre de JMM par rapport aux valeurs initiales a été obtenue chez 58 % des patients sous VyeptiMD vs 39 % des patients sous placebo1,2 (paramètre secondaire majeur)
 D'après la monographie de produit
D'après la monographie de produit
MIGRAINE ÉPISODIQUE – ESSAI PROMISE-1
Une réduction ≥ 75 % du nombre de JMM par rapport aux valeurs initiales a été obtenue chez 31 % des patients sous VyeptiMD vs 20 % des patients sous placebo1,3 (paramètre secondaire majeur)
 D'après la monographie de produit
D'après la monographie de produit
DONNÉES SUR LA CÉPHALÉE PAR ABUS MÉDICAMENTEUX (CAM) ET LA MIGRAINE CHRONIQUE1,4
MIGRAINE CHRONIQUE – ESSAI PROMISE-2
- Au total, 431 patients (40 %) qui avaient reçu un double diagnostic de migraine chronique et de CAM ont été admis à l’étude.
Différence observée entre les traitements quant à la réduction du nombre de JMM1,4 :
- -3 JMM entre VyeptiMD 100 mg et le placebo
- Abus de triptans, de dérivés de l’ergotamine ou d’associations d’analgésiques > 10 jours/mois, ou
- d’acétaminophène, d’acide acétylsalicylique ou d’AINS ≥ 15 jours/mois
Diagnostic de CAM :
JMM = jours avec migraine par mois
*Essai mondial qui a été mené à double insu avec placebo sur des groupes parallèles et dont l’objectif était d’évaluer l’efficacité et l’innocuité de VyeptiMD pour le traitement préventif de la migraine chronique (définie par ≥ 15 à ≤ 26 jours avec céphalée, dont ≥ 8 jours avec migraine) chez l’adulte. Au total, 1072 patients ont été randomisés de façon à recevoir un placebo (n = 366), 100 mg d’eptinézumab (n = 356) ou 300 mg d’eptinézumab (n = 350) toutes les 12 semaines pendant 24 semaines (2 perfusions).
Sur le plan de l’efficacité, le paramètre principal était la variation du nombre moyen de JMM des semaines 1 à 12. Les paramètres secondaires majeurs étaient le pourcentage de répondeurs chez qui le nombre de JMM avait diminué de ≥ 75 % ou plus des semaines 1 à 4 ainsi que des semaines 1 à 12.
†Essai mondial mené à double insu avec placebo sur des groupes parallèles et dont l’objectif était d’évaluer l’efficacité et l’innocuité de VyeptiMD pour le traitement préventif de la migraine épisodique (définie par ≥ 4 et ≤ 14 jours avec céphalée, dont ≥ 4 jours avec migraine durant la période de sélection de 28 jours) chez l’adulte. Au total, 888 patients ont été randomisés de façon à recevoir un placebo (n = 222), 30 mg d’eptinézumab (n = 223), 100 mg d’eptinézumab (n = 221), ou 300 mg d’eptinézumab (n = 222) toutes les 12 semaines pendant 48 semaines (4 perfusions).
Les patients étaient autorisés à prendre en concomitance des médicaments pour le traitement ponctuel de l''épisode migraineux ou de la céphalée, y compris des antimigraineux spécifiques (p. ex., un triptan ou un dérivé de l’ergotamine) durant l’essai. L’utilisation régulière (plus de 7 jours par mois) d’autres traitements pour la prévention de la migraine était interdite. Sur le plan de l’efficacité, les paramètres secondaires majeurs étaient le taux de répondeurs à 75 % des semaines 1 à 4, le taux de répondeurs à 75 % des semaines 1 à 12, le taux de répondeurs à 50 % des semaines
1 à 12 et le pourcentage des patients aux prises avec un épisode migraineux le lendemain de la perfusion.
‡Proportion de patients chez qui le nombre de jours avec migraine par mois a diminué de 75 % ou plus ou encore, de 50 % ou plus, pendant la période précisée, par rapport aux valeurs initiales.
- Monographie de VyeptiMD. Lundbeck Canada Inc.
- Lipton RB et al. Efficacy and safety of eptinezumab in patients with chronic migraine: PROMISE-2. Neurology. 31 mars 2020;94(13):e1365-e1377.
- Ashina M et al. Eptinezumab in episodic migraine: A randomized, double-blind, placebo-controlled study (PROMISE-1). Cephalalgia. Mars 2020;40(3):241-254.
- Diener HC et al. Efficacy, tolerability, and safety of eptinezumab in patients with a dual diagnosis of chronic migraine and medication overuse headache: Subgroup analysis of PROMISE-2. Headache. 2021;61:125-136.
Références :
Information sur l'innocuité
Indications et usage cliniquee :
PrVyeptiMD (eptinézumab pour injection) est indiqué pour la prévention de la migraine chez l’adulte ayant au moins 4 jours avec migraine par mois. VyeptiMD doit être prescrit par un professionnel de la santé ayant de l’expérience dans le diagnostic et le traitement de la migraine.
En l’absence de données recueillies chez les moins de 18 ans, l’utilisation de VyeptiMD n’est pas autorisée chez les enfants.
L’innocuité et l’efficacité de VyeptiMD n’ont pas été établies chez les patients de 65 ans ou plus. Le programme de recherche clinique sur VyeptiMD ne regroupait pas suffisamment de patients de 65 ans ou plus pour nous permettre de déterminer si la réponse de ces patients différait de celle des patients plus jeunes.
Mises en garde et précautions les plus importantes :
Réactions d’hypersensibilité : Des réactions d’hypersensibilité graves, notamment des cas d’œdème de Quincke, d’urticaire, d’éruption cutanée et de réaction anaphylactique ont été signalées au sein de la classe des anti-CGRP, à laquelle appartient VyeptiMD, lors d’essais cliniques et pourraient se manifester quelques minutes après le début de la perfusion. Advenant l’apparition d’une réaction d’hypersensibilité grave, il faut mettre fin immédiatement à la perfusion de VyeptiMD et instaurer le traitement approprié.
Autres mises en garde et précautions pertinentes :
• Patients atteints d’une maladie cardiovasculaire;
• Patients atteints de diabète ou d’obésité morbide;
• Patients présentant une intolérance héréditaire au fructose (IHF);
• Patients atteints d’insuffisance hépatique;
• Patients infectés par le VIH ou atteints d’hépatite B ou C;
• Patients atteints d’un trouble auto-immun;
• Patients atteints d’un trouble neurologique;
• Patients atteints d’insuffisance rénale;
• Fertilité;
• Femmes enceintes;
• Femmes allaitantes.
Pour en savoir plus :
Consultez la monographie du produit. Vous y trouverez des renseignements importants sur les effets indésirables, les interactions médicamenteuses et la posologie qui ne figurent pas dans le présent document. Vous pouvez aussi vous procurer la monographie du produit en appelant au 1 800 586-2325.